CoronaVac aşısının yayınlanan Faz I/II sonuçları ve devam eden Faz III çalışmaları hakkında bilgilendirme
- Aralık 08, 2020
- 4803
Sinovac şirketi tarafından geliştirilen ve adı CoronaVac olan COVID-19 aşısının bilindiği üzere Faz III çalışmasının bir kısmı ülkemizde gerçekleştirilmektedir ve Sağlık Bakanlığı’nın yaptığı açıklamaya göre ülkemiz bu aşıdan 30 milyon doz sipariş vermiştir. Burada CoronaVac’ın Faz I/II sonuçlarının açıklandığı 17 Kasım 2020 tarihli çalışmanın özetlenmesini amaçlanmıştır.
Bu çalışma 18-59 yaş arası Çin’li gönüllerde yapılan randomize çift kör plasebo kontrollü bir çalışmadır.
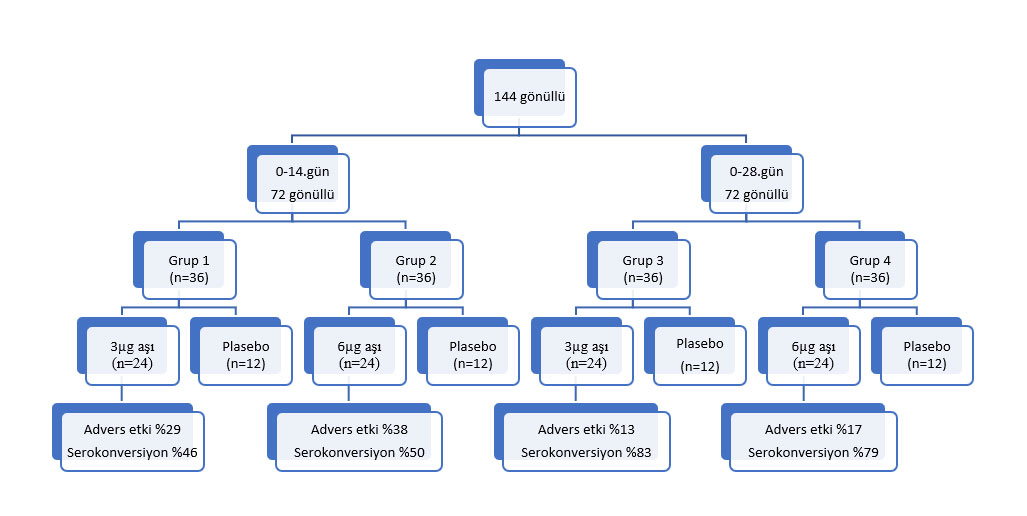
16 Nisan ile 25 Nisan arasında Faz I’de 144 gönüllü 0-14. gün (n=72) ve 0-28. Gün (n=72) şeklinde iki farklı gruba randomize ediliyor. Her gruptaki hastalar 36 hastadan iki eşit alt gruba ayrılıyorlar. Böylelikle 36 hastalık 4 alt grup oluşuyor. Bu 36 hastalık gruplar da 2:1 şeklinde aşı grubu ve de plasebo grubuna ayrılıyorlar. Aşı gruplarındaki hastalara 3µg ve 6µg dozunda aşı uygulanıyor. Adverse etki ve serokonversiyon ve de gruplar arası değişim aşağıdaki şekildeki gibi oluyor.
Şekil 1. Faz I’de yapılan randomizasyon ve de gruplar arasında adverse etki ve serokonversiyon sonuçları
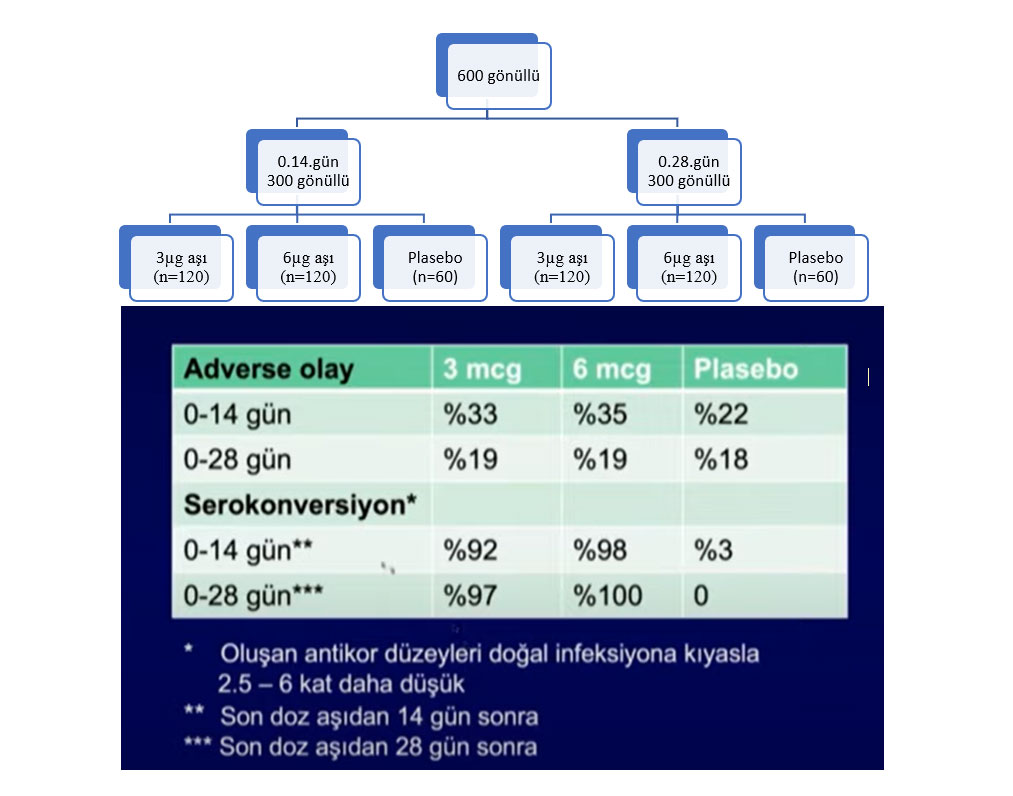
Sonrasında 3 Mayıs ile 5 Mayıs arasında Faz II’ye 600 gönüllü alınıyor. Gönüllüler öncelikle 0.14.gün ve 0.28.gün şeklinde iki alt gruba ayrılıyor. Bu gruplarda 2:2:1 şeklinde 3µg, 6µg ve plasebo şeklinde randomize ediliyor. Sonuçlar (adverse etki ve serokonversiyon) ve de gruplar arası değişim aşağıdaki şekildeki gibi oluyor.
Şekil 2. Faz II’de yapılan randomizasyon ve de gruplar arasında adverse etki ve serokonversiyon sonuçları
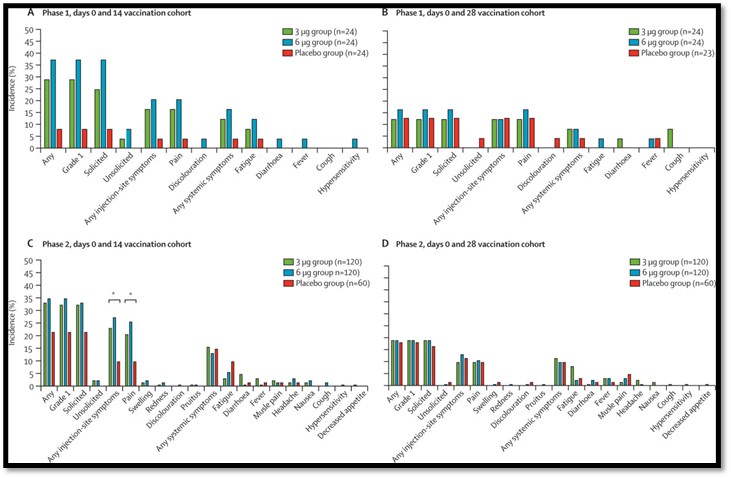
Faz II’de saptanan en yaygın semptom, 3μg grubundakilerin %21’inde, 6μg grubundakilerin %26’sında ve plasebo grubundakilerin %10’unda meydana gelen enjeksiyon bölgesinde ağrı olmuştur. Adverse reaksiyonların çoğu hafiftir (Derece 1) ve katılımcılar 48 saat içinde iyileşmiştir (Şekil 3).
Şekil 3. Faz I/II’de adverse etki insidansı ve gruplara göre dağılımı
Yazarlar Faz II aşamasına geçilmeden önce aşı üretim kapasitesini artırmak için aşı üretiminde yüksek derecede otomatik bir biyoreaktör (ReadyToProcess WAVE 25, GE, Umea, İsveç) kullanılmaya başlandığını belirtiyorlar. Ancak denemenin immünojenisite sonuçları elde edildikten sonra, aşının üretimindeki bu değişikliğin hücre kültürünü optimize ettiğini ve bunun, beklenmedik bir şekilde, Faz II denemesi için kullanılan aşı partilerinde 2 kat artmış spike proteinine (%3.7’den %7.0’a), yani antijenik özellikte 2 kat artışa sebep olduğunu, saptamışlar. Bununla birlikte, yazarlar denemeler için etik onay alındığında, Faz I ve II denemeleri için aşı grupları arasındaki bu antijen seviyesi farkının farkında değillermiş.
Şekil 1 ve 2’deki serokonversiyon oranları incelendiğinde bu antijenitedeki artışın serokonversiyonda belirgin bir artışa sebep olduğu görülmektedir.
Üretim sürecindeki değişim planlanmış olmasına rağmen (yani biyoreaktöre geçiş), aşıların antijenitesindeki fark beklenmeyen bir durumdur ve potansiyel olarak aşı alıcıları için ek riskler getirebilirdi. Neyse ki, görüldüğü gibi Faz I ve II denemelerindeki aşıların güvenlik profilleri benzer bulunmuştur. Yukarıda da belirtildiği gibi Faz II denemesindeki aşılar Faz I’dekilerden önemli ölçüde daha güçlü immünojeniteye sahiptir.
Farklı konsantrasyonlarda ve farklı dozlama programları kullanarak iki doz CoronaVac'ın 18-59 yaş arası sağlıklı yetişkinlerde iyi tolere edildiğini ve orta derecede immünojenisite oluşturduğu saptanmıştır. 3 µg ve 6 µg grubundaki advers reaksiyonların insidansı benzerdir, bu da doza bağlı güvenlik endişelerinin olmadığını göstermiştir. Ancak COVID-19’a karşı geliştirilen her aşı için var olan uzun süreli komplikasyonlar hakkında bir şey söyleyememe durumu CoronaVac içinde geçerlidir.
Yukarıdaki Şekil 2 incelendiğinde, beklendiği gibi, iki doz aşıdan sonra, 0. ve 28. günlerde aşılama programı tarafından indüklenen immün tepki, dozdan bağımsız olarak, 0. ve 14. gün aşılama çizelgesi tarafından indüklenenlerden daha fazla bulunmuştur. Ancak Faz III için 3µg ve 0.-14.gün aşılama programının kullanılmasına karar verilmiştir.
Bunun açıklaması; 1) Acil kullanım için kişi başına doz; aşı üretiminin zor olması nedeniyle ne kadar düşük doz kullanılırsa o kadar çok aşı üretilebilinir, ve 2) Kısa süre içinde hızlı antikor tepkisi; pandemi sürecinde insanlar ne kadar kısa sürede aşılanırsa o kadar bağışık insan oluşturulabilinir, şeklinde yapılmaktadır.
Yayının künyesi; Zhang Y, Zeng G, Pan H, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18–59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. Lancet Infect Dis. 2020 Nov 17;S1473-3099(20)30843-4.
Yazıya ulaşılabilinecek link; Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18–59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial - The Lancet Infectious Diseases
Ülkemiz haricinde bu aşının Faz III çalışmalarının yapıldığı ülkeler ve o ülkelerdeki durum aşağıdaki şekilde özetlenmiştir (Not: Şekil Dr. Murat Akova’nın İTO tarafından düzenlenen Covid-19 Aşılarında Güncel Durum adlı konuşmasından alınmıştır)

Ayrıca Dr. Akova’nın aktardığına göre Çin Hükümeti’nden bu aşı erken kullanım onayı almıştır. 23 Ekim’e kadar yaklaşık 180 bin gönüllünün aşılandığı belirtilmiş ve advers etki oranı %5.1 olarak bildirilmiştir (Not: Şekil Dr. Murat Akova’nın İTO tarafından düzenlenen Covid-19 Aşılarında Güncel Durum adlı konuşmasından alınmıştır. İlgili sunuma bu linkten ulaşılabilinir;

Doç. Dr. Necati Çıtak
İTO COVID-19 İzleme Grubu Üyesi





